RESULTS OF PROSTATE CANCER SCREENING IN NON-SYMPTOMATIC MEN
IOANNIS M. ANTONOPOULOS,
ANTONIO C. L. POMPEO, OMAR R. EL HAYEK,
ÁLVARO S. SARKIS, WLADIMIR ALFER JÚNIOR, SAMI ARAP
Division of Urology, School of Medicine, State University of de São Paulo, USP, São Paulo, SP, Brazil
ABSTRACT
Objectives:
To verify prostate cancer prevalence in non-symptomatic men between 50
and 70 years old as well as cancer characteristics.
Material and Methods: 2815 non-symptomatic
men had total PSA and digital rectal examination performed between March
1998 and April 1998. Racial distribution was: 2331 Caucasians (83.9%),
373 Blacks (13.4%) and 75 Asiatic (2.7%). PSA was normal in 2554 (91.4%),
4 to 10 in 177 (6.3%) and greater than 10 in 64 (2.3%). DRE was normal
in 2419 (86.3%), suspicious in 347 (12.4%) and characteristic for cancer
in 37 (1.3%). Men with abnormal DRE and/or PSA had transrectal prostate
biopsy indicated.
Results: 461 biopsies were done and 78 tumors
was detected (prevalence = 2.8%). Prevalence was progressively higher
with age (p < 0.001), PSA level (p < 0.0001) and DRE findings (p
= 0.0216). Cancer prevalence in Blacks was 1.65 times higher than in Caucasians
(p > 0.05) and 94.9% of detected tumors were moderately or poorly differentiated.
Sensibility, specificity, positive predictive value, negative predictive
value and total accuracy for PSA were respectively: 66.6%; 89.7%; 51.7%;
94.2% and 86.5%. For DRE, the respective values were: 49.1%; 79.4%; 50.9%;
78.3% and 70.3%.
Conclusions: prostate cancer prevalence
in the studied population (2.8%) was similar to that of other countries
populations. Cancer prevalence in blacks was 1.65 times higher than in
Caucasians (difference was not statistically significant). Cancer prevalence
becomes higher with aging. The association of DRE and PSA is of paramount
importance for cancer diagnosis. The great majority of detected tumors
(94.9%) was moderately and poorly differentiated. Brazil probably needs
regional studies to better characterize prostate cancer epidemiology due
to population heterogeneity.
Key words:
prostate; prostatic neoplasm; prostate-specific antigen; screening
Braz J Urol, 27: 227-234, 2001
INTRODUÇÃO
O
adenocarcinoma de próstata (ACP) é a neoplasia interna mais
freqüente no homem sendo a segunda causa de óbito por tumor
nos EUA (1) e a terceira causa de óbito por neoplasias no Brasil
(2). Nos EUA, o National Cancer Institute estimou para 2000, 180.400 novos
casos com aproximadamente 31.900 mortes causadas pela doença (3)
sendo que, no Brasil, o Instituto Nacional do Câncer estimou, para
1999, 14.500 casos novos com uma projeção de 5.000 mortes
pela doença (2).
O objetivo deste trabalho é verificar
a prevalência de ACP em população assintomática
entre 50 e 70 anos bem como as características dos tumores diagnosticados.
MATERIAL E MÉTODOS
Foram
convocados para atendimento entre 30 de março e 3 de abril de 1998,
3000 homens assintomáticos com idades entre 50 e 70 anos, pelos
canais de comunicação de massa, para rastreamento gratuito
de ACP. Compareceram 2815 indivíduos que foram submetidos a exame
físico prostático (EFP) realizado por urologistas, e dosagem
de PSA total (eletroquimioluminescência da Boeringer-Manheim ®,
limite de detecção = 0.03 ng/ml). O valor máximo
da escala de leitura do aparelho foi 100, ou seja, valores mais altos
eram classificados como > 100 independentemente dos níveis que
apresentassem. Os homens foram classificados quanto à etnia pelo
médico examinador em: amarelos, brancos e negros, sendo que negros
eram todos os indivíduos com características físicas
da etnia negra como pele escura, feições negróides
e cabelo típico. Aqueles com traços orientais foram classificados
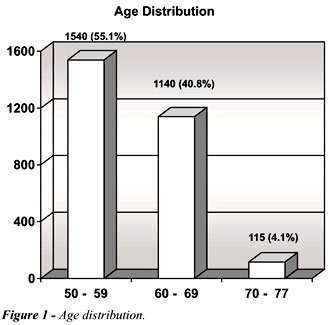
como amarelos e os demais foram considerados brancos. A idade variou de
50 a 77 anos (média = 59), pois foram incluídos 41 homens
com idade entre 71 e 77 anos (Figure-1).
As características da população
estudada estão representadas na Table-1.
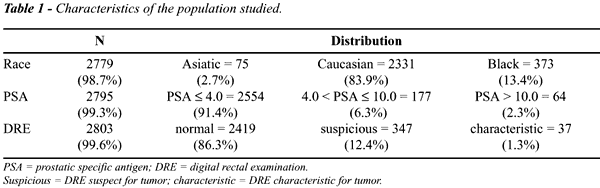
Todos os homens eram residentes no estado
de São Paulo à exceção de 4 deles. Os indivíduos
com PSA maior que 4.0 ng/ml e/ou EFP anormal (presença de nódulos
duros; áreas com aumento de consistência) foram orientados
a realizar biópsia transretal de próstata sendo os pacientes
distribuídos aleatoriamente em 2 grupos: GI – biópsias
guiadas por ultra-som transretal; GII – biópsias orientadas
digitalmente pelo examinador. A técnica utilizada para as biópsias
foi a da retirada de fragmentos por amostragem sextante.
Os dados foram pré-analisados e classificados
em paramétricos (gaussianos) e não-paramétricos (não-gaussianos).
Quando dados paramétricos eram analisados os mesmos foram expressos
em média e desvio padrão. Nas situações em
que a análise se referia a dados não-paramétricos
os mesmos foram expressos em mediana e percentis de 25% e 75%. Sempre
que realizada a análise de dados comparativos (presença/ausência
ou positivo/negativo) foi feito o teste de Qui-quadrado com correção
de Yates ou teste exato de Fisher. Foram considerados significantes os
valores de p < 0.05, ou seja, correu-se risco a = 5% de se cometer
erro de primeira ordem. Para verificar se os resultados observados com
o emprego de um teste ou conjunto de testes foram estatisticamente significantes
em relação aos resultados esperados foi empregado o teste
de Kolmogorov-Smirnov.
RESULTADOS
Foram
indicadas 557 biópsias (557/2815 ou 19.8% da população)
sendo efetivamente realizadas 461 (461/557 ou 17.2% de abstenção).
A distribuição das biópsias segundo a indicação
está demonstrada na Table-2.

Foram diagnosticados 78 tumores resultando
numa prevalência populacional de 2.8%. Das biópsias indicadas,
16.9% foram positivas para tumor sendo necessárias 5.9 biópsias
para detectar um câncer.
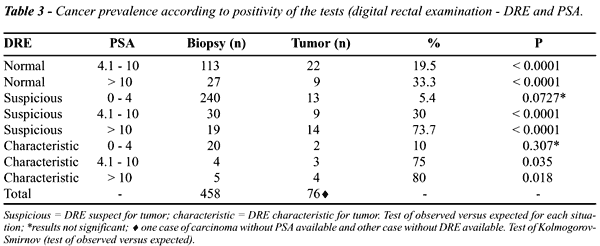
A Table-3 mostra a prevalência de
ACP de acordo com o resultado dos testes (EFP e PSA) empregados em sua
detecção. Cada teste ou associação de testes
empregada foi submetida a estudo estatístico para verificar se
haveria diferença significante na detecção de câncer
com o uso do mesmo.
A Table-4, mostra a prevalência de
tumor nos indivíduos levando-se em conta apenas alterações
do PSA. Sua interpretação mostra que quanto mais alto o
valor do PSA maior o risco de ACP.

Já a Table-5, mostra a prevalência
de tumor nos indivíduos com anormalidades de EFP, independentemente
do uso do PSA. Sua interpretação mostra que quanto mais
alterado o EFP maior a chance de se encontrar tumor muito embora o risco
relativo de uma situação para outra (EFP suspeito versus
característico) seja pequeno.

A prevalência de ACP por faixa etária
pode ser vista na Table-6. Quanto maior a idade, maior o risco de ACP.

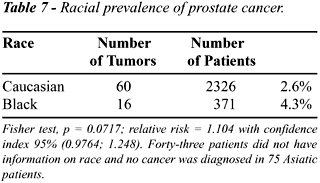
A Table-7 mostra a prevalência de
ACP por etnia sendo a diferença entre brancos e negros marginalmente
significante.
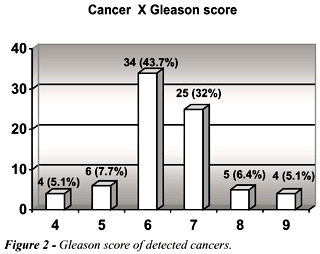
A distribuição dos tumores
pelo escore de Gleason pode ser vista na Figure-2.
A distribuição dos tumores
por faixas de PSA pode ser vista na Figure-3 (um caso sem PSA disponível
para análise).
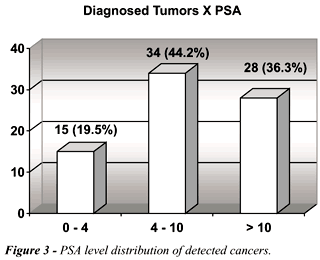
Dos 15 tumores (19.5%) com PSA normal, 4
(5.2%) apresentaram PSA < 1.0 ng/ml (0.4 a 0.8 ng/ml).
A sensibilidade, especificidade, valor preditivo
positivo e negativo bem como acurácia total dos testes empregados
na detecção de câncer podem ser vistos nas Tables-8
e 9.
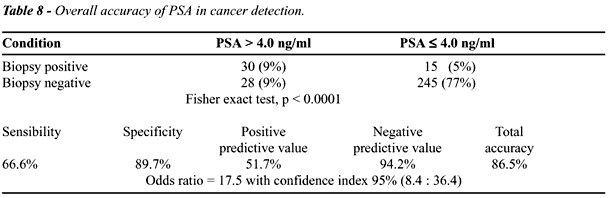
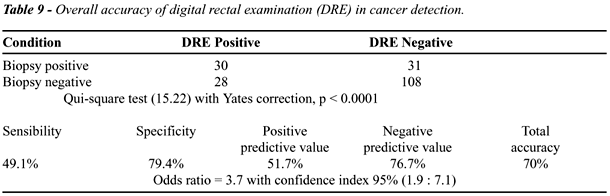
DISCUSSÃO
O
I Consenso Brasileiro do Câncer de Próstata estabeleceu que
é recomendável a realização anual de EFP e
dosagem de PSA nos homens com mais de 50 anos ou acima de 40 anos se forem
negros ou tiverem história de ACP em parentes de primeiro grau
(4). O índice de detecção de ACP em nosso trabalho
(2.8%) foi semelhante ao de outras casuísticas que referem valores
entre 2.6% e 7.2% (5-7). Apesar de ainda não haver provas definitivas
de que programas de rastreamento aumentam a sobrevida dos pacientes com
diagnóstico precoce de ACP, começam a surgir indícios
de queda na mortalidade da doença (8). Este fato pode ser explicado
pelo uso do PSA, que modificou as características dos tumores diagnosticados
(9).
De fato, podemos encontrar PSA alterado
entre 10% e 52.3% dos homens com idade maior ou igual a 50 anos (6,7),
sendo que 15.7% destes apresentam PSA compreendido entre 4.1 e 10.0 ng/ml
(10). Em nossa casuística, o percentual de indivíduos com
PSA alterado não diferiu de modo significante destes relatos, pois
notamos que 8.6% dos homens apresentaram PSA > 4.0 ng/ml. Observe-se
ainda que 6.3% dos indivíduos da nossa casuística apresentaram
PSA entre 4.1 e 10.0 ng/ml o que também não difere expressivamente
dos valores referidos na literatura. Estes dados são importantes
quando consideramos o risco de câncer em cada faixa de PSA, pois,
independentemente do EFP, indivíduos com PSA na faixa 4-10 ng/ml
apresentaram prevalência de 23.1% de tumor em nossa casuística
comparado com 11.3% a 29.4% (11,12) sendo que, acima de 10 ng/ml este
percentual subiu para 53.8%.
Quando comparamos os resultados deste trabalho
com os do rastreamento de ACP feito por Martins et al. na região
de Ribeirão Preto, notamos que, naquela região, a prevalência
de câncer para os indivíduos com PSA entre 4.1 e 10 ng/ml
é de 11.3% e de 43.3% quando o PSA é maior que 10 ng/ml
(12). Como se pode notar, na faixa de PSA entre 4.1 e 10 ng/ml a diferença
da prevalência de câncer entre as 2 casuísticas é
superior a 100% demonstrando heterogeneidade populacional ou metodologia
de estudo não superponível.
Quanto ao EFP, 13.7% dos pacientes apresentavam
anormalidades, número consideravelmente elevado pois a literatura
refere valores menos expressivos (13,14). Alterações no
EFP implicaram maior risco de câncer pois, independentemente do
PSA, EFP suspeito ou característico revelou câncer em 12.7%
e 31% dos casos respectivamente (Table-5), resultados similares aos da
literatura que oscilam entre 21.4% e 50% (15,16). Neste aspecto é
interessante frisar que, embora seja importante que médicos generalistas
também façam o EFP, o número de tumores diagnosticados
por eles será provavelmente menor que por urologistas os quais
apresentam usualmente maior sensibilidade para este exame (17). A variabilidade
inter-examinador pode ser observada também entre urologistas o
que pode ter sido responsável pelo grande número de biópsias
realizadas para detectar um câncer no grupo de pacientes com PSA
normal indicando que muitos homens examinados tiveram a próstata
colocada sob suspeição afetando negativamente a especificidade
do EFP (Tables-8 e 9).
O ACP pode ser detectado em homens com alterações
exclusivas de EFP (Table-3) fazendo com que este seja imprescindível
para o rastreamento da doença. No entanto, número desproporcionalmente
maior de biópsias é necessário para pacientes nesta
situação e seria desejável o uso de critérios
adicionais para indicação de biópsia neste subgrupo.
De fato, quando o PSA está normal, o EFP suspeito ou característico
implica respectivamente, na indicação de 18.5 e 9 biópsias
para se detectar um câncer comprovando sua baixa especificidade.
Quando os pacientes recusam o EFP, devem
ser alertados sobre os riscos de rastreamento baseado exclusivamente no
PSA muito embora seja possível estimar a probabilidade de ACP analisando
apenas a dosagem daquele marcador (Table-4). O percentual, no entanto,
de pacientes com diagnóstico de tumor e PSA normal (19.5%) foi
expressivo apesar da literatura referir valores de até 35% (18).
É igualmente preocupante que 5% dos tumores tenham PSA excepcionalmente
baixo (PSA < 1.0 ng/ml). Estes dados reforçam a importância
do EFP e talvez a necessidade de rever o valor de 4.0 como limite superior
de normalidade. Por outro lado, provavelmente podemos prescindir do EFP
em homens cujo PSA seja menor de 0.4 ng/ml, pois, abaixo deste valor não
encontramos câncer em nossos pacientes. O número de pacientes
com PSA < 0.4 ng/ml foi igual a 252 o que corresponde a 9% do total.
Em termos populacionais o número é considerável pois
implica que 1 em cada 11 homens poderia eventualmente prescindir do EFP.
Merece grande destaque a associação
de EFP com PSA, pois, nestas condições, a chance de se detectar
tumor variou de 30% a 80% (Table-3). Em que pesem as particularidades
de cada situação, analisando globalmente, foram necessárias
5.9 biópsias para detectar um câncer comprovando que medidas
propedêuticas adicionais são necessárias para melhorar
a especificidade do rastreamento.
Concordando com dados da literatura, a idade
foi fator de risco para ACP (19). Por outro lado, ao contrário
de outras publicações (20), a maior prevalência de
ACP em negros do que brancos não alcançou significância
estatística o que provavelmente significa que a população
brasileira é diferente daquela estudada em outros países
ou que a maior miscigenação observada em nosso meio dificulta
a melhor caracterização do fator racial.
A análise da graduação
histológica dos tumores diagnosticados pela biópsia mostrou
que a grande maioria (94.9%) foi moderadamente diferenciada ou indiferenciada,
um indício de que tumores detectados em programas de rastreamento
são biologicamente mais importantes do que aqueles encontrados
incidentalmente em autópsias (19).
CONCLUSÕES
A
prevalência de ACP na amostra estudada (2.8%) foi similar à
descrita em outras populações.
A prevalência em negros foi de 4.3%
e em brancos de 2.6%. A diferença de prevalência entre brancos
e negros não atingiu nível de significância estatística
embora tenha sido 1.65 vezes mais alta em negros.
A prevalência de ACP aumenta progressivamente
com a idade.
A associação de EFP e PSA
é fundamental para o diagnóstico de câncer de próstata.
Os tumores encontrados foram, em sua maioria
(94.9%) moderadamente diferenciados ou indiferenciados.
O Brasil, por suas dimensões continentais
e população etnicamente heterogênea necessita de estudos
epidemiológicos regionais.
__________________________________
Isac Castro realizou a análise estatística.
Alexsandro Gomes da Silva e Fátima Jesus
forneceram apoio em informática.
REFERÊNCIAS
- Kleer E, Oesterling JE: PSA and staging of localized prostate cancer. Urol Clin North Am, 20: 695-704, 1993.
- INCA Instituto Nacional do Câncer. Dados disponíveis pelo site URL: http:www.inca.org.br Instituto Nacional do Câncer, maio, 2000.
- Greenlee RT, Murray T, Bolden S, Wingo PA: Cancer statistics, 2000. CA Cancer J Clin, 50: 7-33, 2000.
- Damião R, Aguinaga SD, Pompeo ACL: História Natural do Câncer de Próstata. In: I Consenso Brasileiro do Câncer de Próstata. Rio de Janeiro, Editora BG Cultural: pp.1-12, 1998.
- Mäkinen T, Määttanen L, Stenman U, Hakama M, Rannikko S, Aro J, Juusela H, Auvinen A, Tammela T: Detection of clinically organ-confined prostate cancer is increased in the Finnish screening trial. Program and abstracts from the American Urological Association 95th Annual Meeting; Atlanta, Georgia. Abstract 385, 2000.
- Catalona WJ, Hudson MA, Scardino PT, Richie JP, Ahmann FR, Flanigan RC, Dekernion JB, Ratliff TY, Kavoussi LR, Dalkin BL, Waters WB, Macfarlane MT, Southwick PC: Selection of optimal prostate specific antigen cutoffs for early detection of prostate cancer: receiver operating characteristics curves. J Urol, 152: 2037-2042, 1994.
- Colberg JW, Smith DS, Catalona WJ: Prevalence and pathological extent of prostate cancer in men with prostate specific antigen levels of 2.9 to 4.0 ng/ml. J Urol, 149: 507-509, 1993.
- National Center for Health Statistics. Available from Internet: URL: http:www.nci.nih.gov National Cancer Institute, Dezembro, 1997.
- Soh S, Kattan MW, Berkman S, Wheeler TM, Scardino PT: Has there been a recent shift in the pathological features and prognosis of patients treated with radical prostatectomy? J. Urol, 157: 2212-2218, 1997.
- Stamey TA, Mcneal JE: Adeno Carcinoma of the Prostate. In: Walsh PC, Retik AB, Stamey TA, Vaughan ED Jr (eds.). Campbell’s Urology. Philadelphia, WB Saunders, pp.1159-1221, 1992.
- Schmid HP, Ravery V, Billebaud T, Toublanc M, Boccon-Gibod LA, Hermieu JF, Delmas V, Boccon-Gibod L: Early detection of prostate cancer in men with prostatism and intermediate prostate-specific antigen levels. Urology, 47: 699-703, 1996.
- Martins ACP, Cologna AJ, Suaid HJ, Maciel LMZ, Falconi RAR, Rocha JN, Yamasaki R: A importância do PSA e do toque retal no diagnóstico precoce do câncer prostático. Acta Cirúrgica Brasileira, suplemento 1: 40-43, 1998.
- Ornstein DK, Rao GS, Smith DS, Ratliff TL, Basler JW, Catalona WJ: Effect of digital rectal examination and needle biopsy on serum total and percentage of free prostate specific antigen levels. J Urol, 157: 195-198, 1997.
- Thompson IM, Ernst JJ, Gangai MP, Spence R: Adenocarcinoma of the prostate: results of routine urological screening. J Urol, 132: 690-692; 1984.
- Kozlowski JN, Grayhack JT: Carcinoma of the Prostate. In: Gillenwater JY, Grayhack JT, Howards SS, Duckett JW (eds.). Adult and Pediatric Urology. 3. ed., St. Louis, Mosby Yearbook, pp. 1575-1713, 1996.
- Catalona WJ, Richie JP, Ahmann FR, Hudson MA, Scardino PT, Flanigan RC, deKernion JB, Ratliff TL, Kavoussi LR, Dalkin BL: Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6.630 men. J Urol, 151: 1283-1290, 1994.
- Smith DS, Catalona WJ: Interexaminer variability of digital rectal examination in detecting prostate cancer. Urology, 45: 70-74, 1995.
- Partin AW, Pound CR, Clemens JQ, Epstein JI, Walsh PC: Serum PSA after anatomic radical prostatectomy: the Johns Hopkins experience after 10 years. Urol Clin North Am, 20: 713-725, 1993.
- Dhom G: Epidemiologic aspects of latent and clinically manifest carcinoma of the prostate: classification and grading of prostatic carcinoma. Recent results. Cancer Res, 60: 14-26, 1977.
- Myers RE, Wolf TA, Balshem AM, Ross EA, Chodak GW: Receptivity of African-American men to prostate cancer screening. Urology, 43: 480-487, 1994.
_________________________
Received:
November 28, 2000
Accepted after revision: June 19, 2001
_______________________
Correspondence address:
Dr. Ioannis Michel Antonopoulos
Rua Jaraguá,192
São Paulo, SP, 01129-000, Brazil
Fax: + + (55) (11) 3225-9505
E-mail: antonop@ig.com.br